“浙大二院”微信公众号
在肿瘤治疗领域,化疗是非常常见的一种治疗方式,它的毒副作用也为大家熟知,常见的有发热、恶心、呕吐,严重者可发生免疫性肝炎、免疫性肺炎、免疫性肠癌、免疫性心脏炎症甚至免疫性神经系统炎症等。
肿瘤细胞似乎是一种“有智商”的细胞,它可以躲过人体免疫系统的攻打,这就被称之为“免疫逃逸”,这也是癌症始终难以攻克的原因。目前国际上有种先进的治疗方法,叫“吲哚胺2,3-双加氧酶(IDO)抑制剂”治疗,它可以使免疫细胞恢复活性,促进免疫系统杀伤癌细胞。
化疗药物与IDO抑制剂联合应用,可显著激活人体抗肿瘤免疫反应、提升疗效,有望成为临床治疗恶性肿瘤的一缕曙光。
化疗药物与IDO抑制剂联合应用,化疗的副作用依然存在,这将影响该疗法的应用和普及。
近日,浙江大学医学院附属第二医院院长、肝胆胰外科学科带头人王伟林教授和浙江大学高分子系毛峥伟教授团队在国际顶级期刊《先进材料》(IF 30.849)发表封面文章。团队利用金纳米粒子(AuNP)对金属有机框架(MOF)进行原位杂化,从而获得具有同时递送化疗药物和免疫增敏药物的纳米载体。
论文链接:https://doi.org/10.1002/adma.202102188
浙大二院研究团队针对上述肿瘤治疗的难题,跨领域深度交叉融合,研究出了一种纳米载体,我们可以把它看做是一枚“光控制导的肿瘤导弹”,它可以同时运载化疗药和IDO抑制剂,安全抵达肿瘤区域,精准药物投递,全程尽可能减少药物对全身的影响,从而达到提高疗效,减轻副作用的目的,为进一步的临床应用打下了基础。
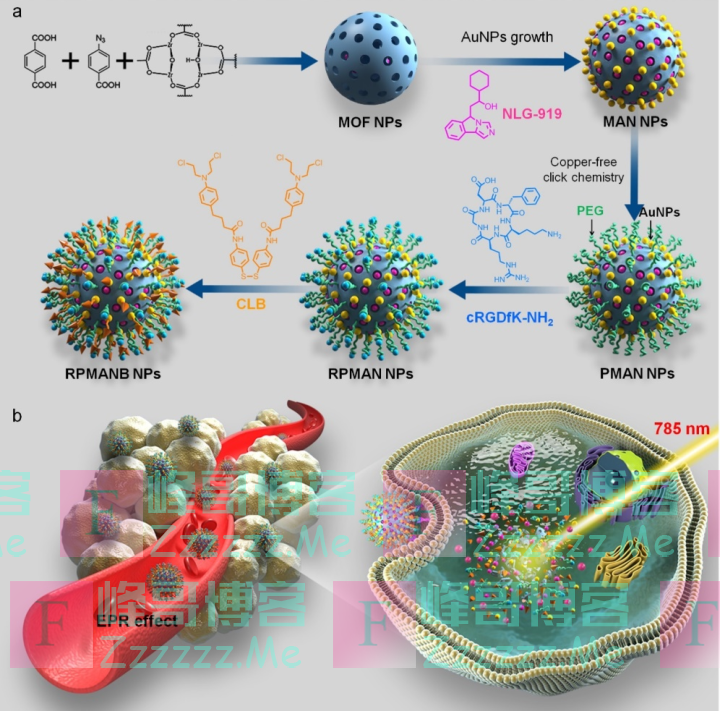
新型抗肿瘤药物合成及效果示意图
开发新型药物
修补组合疗法缺陷
肿瘤免疫治疗是近年来新兴的肿瘤治疗方式。人体免疫细胞抗击肿瘤,需要对肿瘤抗原识别和呈递。一旦肿瘤隐藏自身特异性抗原使得其无法被免疫系统识别,就无法产生抗肿瘤免疫反应。免疫治疗的原理即解除肿瘤这种隐身特性,激活免疫细胞识别、杀伤肿瘤。
根据临床统计,由于肿瘤具有异质性,在接受肿瘤免疫治疗后只有一小部分患者体内发生了有效的T细胞杀伤肿瘤细胞的免疫反应。
“肿瘤细胞抗原能刺激特定的免疫细胞,使免疫细胞活化、增殖、分化,最终产生抗体和效应T细胞,这一特性被称为肿瘤免疫原性。”王伟林教授介绍,由于肿瘤免疫原性较弱,很难引起强烈免疫杀伤反应。“这是肿瘤逃避机体免疫监视、免疫治疗效果不佳的重要机制。”
化疗药物可以诱导肿瘤细胞强烈、持续的免疫原性死亡,增强肿瘤对免疫治疗的敏感程度,从而增强免疫治疗的有效性。
此时,再利用IDO抑制剂,可以进一步激活T细胞产生免疫反应最终消灭肿瘤组织,提高化疗的疗效。
“目前IDO抑制剂并未批准上市,但从2015年起,在国际范围内,IDO抑制剂与化疗药联用的临床试验就已经初步开展,目前多项临床研究已经进入三期,正式进入临床应用指日可待。”王伟林教授说,化疗药物和IDO抑制剂相辅相成,但他们进入人体后,由于非特异性富集,仍会造成一定的副作用影响患者的生活质量,相关副作用包括发热、恶心、呕吐等等,严重者可发生免疫性肝炎、免疫性肺炎、免疫性肠癌、免疫性心脏炎症甚至免疫性神经系统炎症等。
研究团队此次开发的纳米药物,力求以最小的剂量,精准靶向肿瘤并通过近红外光响应释放技术激活化疗药物和IDO抑制剂,激活人体抗肿瘤免疫反应,提升疗效的同时保证患者的生活质量。

浙大二院院长王伟林教授(右一)团队
近红外光控制
肿瘤部位靶向激活
近年来,金纳米粒子因具有表面等离子共振吸收的特性被广泛用于生物传感和医学检测。例如新冠病毒的胶体金检测法,修饰了抗体的胶体金在和抗原(如病毒)结合后产生检测信号。4-氨基苯硫醇可与金纳米粒子结合,并在光照下被金表面等离子激元催化形成二聚体,提升信号强度。
研究团队从中得到启发,尝试利用其与金纳米粒子结合发生二聚化的特性,开展药物光控释放的研究。通过将化疗药物苯丁酸氮芥和4-氨基苯硫醇通过酰胺化形成前药,借助金与硫醇之间的相互作用将前药固定在金纳米粒子上。当光照后金纳米粒子表面形成的等离子激元震荡诱导4-氨基苯硫醇形成二聚体时,原本与4-氨基苯硫醇结合的化疗药物就会被释放出来。
“光具有非常好的可控性,但通过光来控制药物释放,以往并不多见,需要先解决一项技术难题。”毛峥伟教授介绍,过去通常只能做到使用紫外光、可见光等低波段的光,这些光波长短、穿透性很差。“但近红外光的穿透性相比于它们大大提升,从表层的几个微米增加到了几个厘米的厚度,使得光控释药物在体内更容易实现。”
研究团队用近红外光照射肿瘤部位后,肿瘤部位富集的纳米药物响应性定点释放,从而显著地减少对正常细胞的损害。

小编翻译了下,可以这么理解:类似上图,在光照的情况下,药物和金纳米粒子的连接被切断,里面的药物随之渗透到肿瘤细胞,从而产生作用。
此外,该前药合成步骤少,仅仅使用了酰胺化之类简单温和的反应,4-氨基苯硫醇价格低廉(1g只需0.6元),反应产率约为56%,且原料用量较少,成本不高,有很大的推广潜力。
防止血液干扰
运输载体武装改造
“对化疗药物进行光控改造后,团队利用金纳米粒子对金属有机框架进行原位杂化。”毛峥伟教授解释道,就是将氯金酸溶液加入金属有机框架中,通过一系列化学反应在金属有机框架表面生长金纳米粒子,整体外形像表面长了很多芝麻的面包。


小编翻译了下,可以这么理解:这颗药物的金属有机框架,就像一个笼子(左图),金纳米粒子就像面包上的芝麻,会在面包上长大,逐渐变成了右图这样子。
本次研究中,金纳米粒子起到的是前药载体和近红外响应器的作用。金属有机框架的主要作为整个纳米药物的基质,并且通过疏水作用将IDO抑制剂吸附在其孔道内,起到载药的作用。
“还有一个问题是,药物在体内易被血液中的蛋白结合并被巨噬细胞清除。”毛峥伟教授说。
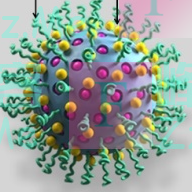
团队使用聚乙二醇和cRGDfK多肽对载体进行结构修饰(如上图的绿毛毛卷,它就像一层伪装外套,使得药物可以顺利地在血管中航行),使其具备高度的血循环稳定性和肿瘤靶向特异性,使纳米药物可以持续、稳定、精准地投递到肿瘤部位,并进行富集,再利用近红外光对肿瘤部位的药物进行光控激活,实现精准肿瘤治疗。
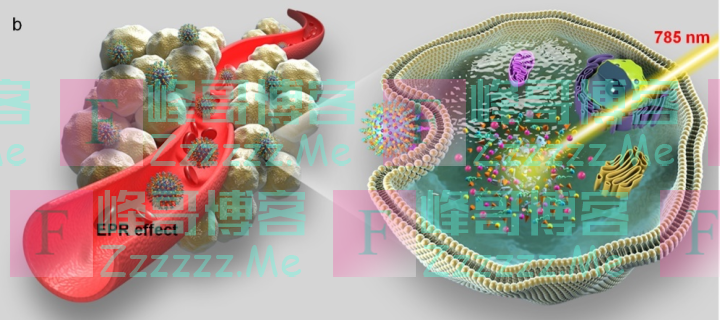
如图所示:
左图中,像丸子一样的就是肿瘤细胞,像毛刺球的就是研究的药物。药物富集在肿瘤细胞区域。
右边的大图即模拟一颗药物受到光照后的状态:纳米载体进入肿瘤细胞后降解,经光照释放药物,药物渗透进肿瘤细胞,精准打击肿瘤。
通过荧光成像显示这种抗癌药物能够被肿瘤细胞特异性吞噬,在激光照射的控制下只有肿瘤部位才能特异性激活,不会在光照区域以外的正常组织被激活,因此大大避免了纳米药物的副作用。
“在治疗期间,注射纳米药物的小鼠体重没有明显减轻,而且没有监测到明显的毒性症状。”丁元博士表示,我们认为该药物是较为安全的,后续将要开展长期深入的安全性研究。
“目前该新型抗肿瘤药物已完成小动物实验,验证了其有效性和安全性,团队准备进一步在大动物上系统评估该药物的生物安全性,为临床研究奠定基础。”王伟林教授表示,团队同时在攻关该纳米药物大规模稳定生产的方法,以期尽早实现该药物的产业化发展,为肝胆胰肿瘤患者带去福音。
(原题为《浙大二院研究新成果:光控靶向药物载体精准激活抗肿瘤免疫反应》。编辑张钟文)
文章如无特别注明均为原创!
作者:
F_Robot,
转载或复制请以
超链接形式 并注明出处 峰哥博客。
原文地址《
浙大二院研究新成果:光控靶向药物载体精准激活抗肿瘤免疫反应》发布于2021-8-14
若您发现软件中包含弹窗广告等还请第一时间留言反馈!
小米手机无法安装请到设置->开发者设置->关闭系统优化,安装后再开启系统优化。





